La guia definitiva de les bateries
La següent guia és molt informativa, per tant, cerqueu el que voleu aprendre de la taula de contingut en funció del vostre nivell de coneixement de la bateria.Per descomptat, si sou un principiant, comenceu al principi.
Consell prèvia a la lectura: Feu clic una vegada al quadre de text del títol i el text detallat s’expandirà;Feu clic de nou i el text detallat s’amagarà.
Presentació
- La importància i les aplicacions generalitzades de les bateries.
-
Les bateries són molt importants a la societat moderna i s’utilitzen en una àmplia gamma d’aplicacions (amb el desenvolupament de la tecnologia, cada vegada més dispositius es converteixen en potència de la bateria).Proporcionen solucions de potència portàtils, renovables i d’emergència que impulsen el desenvolupament tecnològic, l’ús d’energia sostenible i el progrés en una àmplia gamma d’indústries.

1. Dispositius electrònics portàtils: Com ara telèfons mòbils, tauletes, ordinadors portàtils i càmeres digitals.
2. Transport: Els vehicles elèctrics i híbrids utilitzen bateries com a dispositiu principal d'emmagatzematge d'energia.Amb l’augment de la demanda d’energia renovable i els modes de transport respectuosos amb el medi ambient, les bateries tenen un paper clau en la conducció del desenvolupament del transport sostenible.
3. Emmagatzematge d’energies renovables: Les bateries s’utilitzen àmpliament per emmagatzemar fonts d’energia renovables com l’energia solar i eòlica.Emmagatzemant energia elèctrica a les bateries, poden proporcionar un subministrament constant d’electricitat quan no estigui disponible l’energia solar o eòlica.
4. Energia d'emergència: Les bateries tenen un paper important com a font d’energia de còpia de seguretat en situacions d’emergència.Per exemple, dispositius com telèfons sense fil, torxes i llums d’emergència requereixen que les bateries proporcionin energia fiable.
5. Equip mèdic: Molts dispositius mèdics, com ara marcapasos i ventiladors artificials, utilitzen les bateries com a font d’alimentació.L’estabilitat i la fiabilitat de les bateries és fonamental per al funcionament d’aquests dispositius crítics.
6. Aplicacions militars: Les bateries s'utilitzen en una àmplia gamma d'aplicacions militars, com per exemple per a equips de comunicació militar, sistemes de navegació i drons.Les bateries poden proporcionar un subministrament d’energia independent i millorar les capacitats de combat al camp de batalla.
7. Industrial: Les bateries s'utilitzen a la indústria per a sistemes de bateries, fonts d'alimentació d'emergència i sensors sense fils.Proporcionen una font d’alimentació fiable i asseguren la continuïtat i la seguretat de la producció industrial.
- Una visió general dels principis fonamentals i dels mecanismes de treball de les bateries.
-
La màgia de les bateries rau en la seva capacitat de convertir l’energia química en energia elèctrica.Una bateria inclou dos elèctrodes (positius i negatius) i un electròlit.L’electròlit actua com a conductor d’ions, permetent una reacció química entre els elèctrodes.
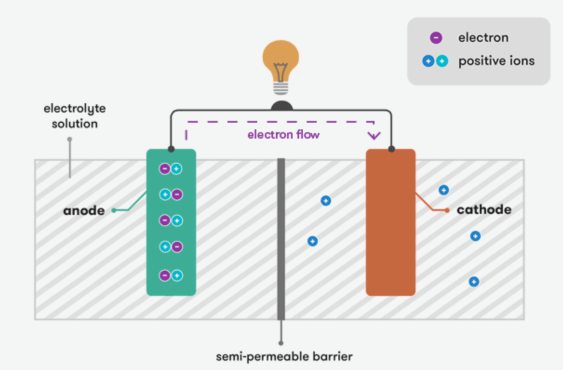
El principi fonamental d’una bateria es basa en reaccions electroquímiques.Quan es produeix una reacció química, genera el flux d’electrons.En estat carregat, la bateria emmagatzema productes químics entre els elèctrodes positius i negatius, i la reacció química és reversible.Quan la bateria està connectada a un circuit extern, comença la reacció química, provocant que el producte químic al terminal positiu s’oxidi i el producte químic al terminal negatiu per reduir -la.Com a resultat, els electrons flueixen des del terminal negatiu fins al terminal positiu, produint un corrent elèctric.Aquest procés continua fins que s’esgoten els productes químics.
Diferents tipus de bateries utilitzen reaccions químiques diferents per generar electricitat.Per exemple, el tipus de bateria d’ions de liti més comú: el seu elèctrode positiu està format per un compost de liti (com l’òxid de cobalt o el fosfat de ferro de liti) i el seu elèctrode negatiu està format per un material de carboni (com el grafit).En estat carregat, els ions de liti s’incorporen a partir de l’elèctrode positiu al material negatiu.Durant la descàrrega, els ions de liti es desembarquen de l'elèctrode negatiu i tornen a l'elèctrode positiu, alliberant electrons.
- El valor de tenir una guia definitiva sobre bateries per als lectors.
-
Una guia definitiva és valuosa per al lector per diverses raons:
1. Per proporcionar informació precisa: Internet està ple de fragments d'informació i opinions conflictives.Una guia definitiva proporciona informació completa i precisa, consolidant i recollint fonts fiables per ajudar els lectors a accedir ràpidament als coneixements que necessiten i evitar informació enganyosa o incorrecta.
2. Estalvieu temps i esforç: La cerca a Internet per obtenir temes específics sovint requereix una gran quantitat de temps per aprofundir i verificar la fiabilitat de la informació.La guia final estalvia temps i esforç mitjançant la reunió d’informació rellevant perquè els lectors puguin trobar tota la informació que necessiten en un sol lloc.
3. Resoldre contradiccions i confusió: Internet sovint presenta respostes diferents a la mateixa pregunta o contradiccions entre informació.La guia definitiva ajuda els lectors a escapar de la confusió i el desconcert, sintetitzant diferents opinions i fonts autoritàries per donar les respostes més fiables.
4. Proporcionar orientació i assessorament: La guia definitiva no només proporciona fets i informació, sinó que també pot proporcionar orientació i assessorament pràctics.
- Diferents tipus de bateries: principis, característiques i aplicacions.
-
A continuació, es mostren alguns dels cinc tipus de bateries més comuns, inclosos els seus principis, característiques i aplicacions.Si voleu la informació més completa dels tipus de bateries, també podeu ometre aquesta secció i anar directament a "la majoria de tipus de bateries i aplicacions" a continuació.
Bateries de plom-àcid
•Principi: Les bateries de plom-àcid utilitzen una reacció química entre el plom i el diòxid de plom per produir energia elèctrica.
•CARACTERÍSTIQUES: COSTES DE BAIXE, ALTA Densitat de corrent i energia de partida, però gran i pesada.
•Aplicacions: bateries d’arrencada d’automòbils, UPS (font d’alimentació ininterrompuda), etc.
Bateries de ions de lit (i ions de liti)
•Principi: Les bateries d’ions de liti utilitzen la migració d’ions de liti entre elèctrodes positius i negatius per emmagatzemar i alliberar energia elèctrica.
•Característiques: alta densitat energètica, pes més lleuger i vida cicle més llarga.Alta eficiència de càrrega i descàrrega.
•Aplicacions: dispositius mòbils (per exemple, telèfons mòbils, ordinadors de tauletes), dispositius electrònics portàtils i vehicles elèctrics.
Bateries NICD (níquel-cadmi)
•Principi: les bateries NICD produeixen energia elèctrica mitjançant una reacció química entre el níquel i el hidròxid de cadmi.
•Característiques: sortida d’alta potència i llarga vida, però contenen el nocador cadmi Heavy Metal, que té un cert impacte en el medi ambient.
•Aplicacions: càmeres digitals, eines portàtils i drons, etc.
Bateries d'hidrur de NIMH (níquel-metall)
• Principi: les bateries NIMH utilitzen la reacció química entre el níquel i l’hidrogen per emmagatzemar i alliberar energia elèctrica.
•Característiques: alta densitat energètica, llarga vida, sense contaminació i millor rendiment a alta temperatura.
•Aplicacions: vehicles híbrids, sistemes d’emmagatzematge d’energia, etc.
Bateria Lipo (polímer de liti)

•Principi: La bateria de polímer de liti és similar a la bateria d’ions de liti, però utilitza un electròlit de polímer sòlid en lloc d’un electròlit líquid.
•Característiques: alta densitat d’energia, pes més lleuger, millor seguretat i menor taxa d’auto-descàrrega.Apte per a dispositius prims.
•Aplicacions: ordinadors portàtils, rellotges intel·ligents i dispositius mèdics portàtils, etc.
- Coneixement de la física de les bateries
- Tensió (V):
La tensió representa la diferència de potencial elèctric entre dos punts d’un circuit.Es mesura en volts (v).La tensió a través d'una bateria normalment es denota com a V_BATT.
Càrrec (q):
La càrrega fa referència a la quantitat de càrrega elèctrica emmagatzemada en una bateria.Es mesura en coulombes (c) o ampere-hores (AH).La relació entre la càrrega i la capacitat és donada per: Càrrega (q) = capacitat (c) × tensió (v)
Capacitat (c):
La capacitat representa la quantitat de càrrega que pot emmagatzemar una bateria.Es mesura normalment en hores d’ampere (AH) o Milliampere-hores (MAH).La relació entre capacitat, càrrega i energia ve donada per: Energia (e) = capacitat (c) × tensió (v)
Energia (e):
L’energia és la capacitat de fer el treball o el potencial que un sistema causi canvis.En el context de les bateries, l’energia sovint es mesura en hores de watt (WH) o Joules (J).La relació entre energia, capacitat i càrrega ve donada per: Energia (e) = càrrega (q) × tensió (v)
Potència (P):
La potència representa la velocitat amb què es fa el treball o es transfereix energia.Es mesura en watts (w).La potència d’un circuit es calcula mitjançant la fórmula: Potència (p) = tensió (v) × corrent (i)
Connexió de sèries:
1. Quan les bateries es connecten en sèrie, la tensió total a través del circuit és la suma de les tensions de la bateria individuals.El corrent continua sent el mateix.
Tensió total (v_total) = v1 + v2 + v3 + ...
2. Quan les bateries estan connectades en sèrie, la capacitat total és la suma de les capacitats de la bateria individuals.Això es deu al fet que el corrent continua sent el mateix, però la tensió total augmenta.
Capacitat total (C_Total) = C1 + C2 + C3 + ...
Connexió paral·lela:
1. Quan les bateries es connecten en paral·lel, la tensió total continua sent la mateixa que la d’una bateria individual, mentre que el corrent total és la suma dels corrents que flueixen per cada bateria.
Corrent total (i_total) = i1 + i2 + i3 + ...
2. Quan les bateries es connecten en paral·lel, la capacitat total és igual a la capacitat d’una sola bateria.Això es deu al fet que la tensió continua sent la mateixa, però el corrent total augmenta.
Capacitat total (C_Total) = C1 = C2 = C3 = ...
- Termes i definicions comunes de la bateria.
-
1. Capacitat de la bateria: La quantitat d’energia elèctrica que pot emmagatzemar una bateria, normalment expressada en hores d’amplificacions (AH) o Milli-AMPS (MAH).
2. Voltatge: La diferència de potencial o la diferència de tensió d’una bateria, expressada en volts V. Representa la quantitat d’energia elèctrica que la bateria pot emmagatzemar.
3. Cel·la de la bateria: Una cel·la individual d'una bateria, que conté l'elèctrode positiu, l'elèctrode negatiu i l'electròlit.
4. Paquet de la bateria: Un conjunt format per diverses cèl·lules de la bateria combinades.Normalment es connecten i es gestionen a través de connectors, plaques de circuit i altres components.
5. Connexió de sèries: Múltiples cel·les de bateria connectades en seqüència, amb el terminal positiu connectat al terminal negatiu, per augmentar la tensió total.Quan es connecten en sèrie, les tensions de la cel·la estan superposades.
6. Connexió paral·lela: Connecta múltiples cel·les de bateries en seqüència, amb el terminal positiu connectat al terminal negatiu, per augmentar la capacitat i la capacitat de corrent totals.Quan es connecta en paral·lel, s’afegeixen les capacitats de les cèl·lules de la bateria.
7. Carregant: Alimentar energia elèctrica a la bateria des d’una font externa per restaurar l’energia química emmagatzemada a la bateria.
8. Descarregar: L’alliberament d’energia elèctrica d’una bateria per utilitzar -la en el subministrament d’equips o circuits electrònics.
9. Cicle de càrrega: Es refereix a un procés complet de càrrega i descàrrega.
10. Eficiència de càrrega: La relació entre l’energia elèctrica absorbida per la bateria i l’energia elèctrica realment emmagatzemada durant el procés de càrrega.
11. Descàrrega pròpia: La velocitat amb la qual una bateria perd energia per si mateixa quan no s’utilitza.
12. Vida de la bateria: La vida útil d’una bateria, generalment mesurada en termes del nombre de cicles de càrrega o temps d’ús.
13. Vida de la bateria: La quantitat de temps que una bateria pot continuar subministrant energia després d'una sola càrrega.
14. Càrrega ràpida: Una tecnologia de càrrega que proporciona energia a la bateria més ràpidament per reduir el temps de càrrega.
15. Sistema de gestió de bateries (BMS): Un sistema elèctric que supervisa i controla l'estat de la bateria, el procés de càrrega i descàrrega i protegeix la bateria de condicions adverses com la sobrecàrrega i la sobrecàrrega.
16. Cicle de la bateria Vida: El nombre de cicles de càrrega que es pot completar una bateria, normalment mesurada mitjançant la càrrega i la descàrrega a una pèrdua de capacitat específica, com ara el 80% de la capacitat original.
17. Taxa de càrrega màxima: La taxa de càrrega màxima que pot ser acceptada de forma segura per la bateria, expressada com a relació de la capacitat de càrrega.
18. Taxa màxima de descàrrega: La velocitat de corrent màxima a la qual es pot descarregar una bateria amb seguretat, expressada com a relació de capacitat de corrent.
19. Circuit de protecció de la bateria: Un dispositiu de seguretat que s’utilitza per controlar l’estat de la bateria i per desconnectar el circuit de la bateria en cas de sobrecàrrega, sobrecàrrega, sobrecurrent, excés, etc., per evitar danys o perill per a la bateria.
20. Polaritat de la bateria: La distinció i la identificació entre els terminals positius i negatius d'una bateria, generalment indicats pels símbols + i - o marques.
21. Reciclatge de la bateria: El procés d’eliminació de les bateries usades per recuperar i disposar dels materials perillosos que hi ha i de reutilitzar materials reciclables.
22. Descàrrega profunda: Una condició en què es descarrega una bateria a un nivell molt baix o completament esgotat.La descàrrega profunda no sol recomanar -se freqüentment per evitar efectes negatius sobre la durada de la bateria.
23. Descàrrega ràpida: Una tècnica de descàrrega que allibera l’energia de la bateria a un corrent elevat durant un curt període de temps.
24. Fallada de la bateria: Una condició en què la bateria no pot proporcionar una potència suficient o mantenir un funcionament normal, que pot ser causada per diverses raons com l’envelliment o el dany.
25. Fugida tèrmica : Es refereix a l’augment ràpid i incontrolable de la temperatura d’una bateria en condicions anormals, com ara sobrecàrrega, sobrecàrrega, sobreescalfament, etc., que pot fer que la bateria exploti o s’incendi.
26. Elèctrodes de la bateria: Els elèctrodes positius i negatius en una bateria, que són els components clau per emmagatzemar i alliberar la càrrega elèctrica.
27. Estació d'intercanvi de bateries: Una instal·lació o servei per a la ràpida substitució de les bateries en vehicles elèctrics per proporcionar un abast més llarg.
28. Reacció electroquímica: La reacció química que es produeix en una bateria per convertir l’energia química en energia elèctrica mitjançant un procés redox.
29. Electròlit: Un líquid conductor o sòlid usat per transportar ions entre els elèctrodes positius i negatius d’una bateria per facilitar la reacció electroquímica.
30. Carregador: Un dispositiu per transferir energia elèctrica a una bateria per restaurar la seva energia química emmagatzemada.
31. Equilibri de la bateria: Un procés pel qual s’ajusta la velocitat de càrrega o de descàrrega de cada cel·la en un paquet de bateries per assegurar -se que la càrrega s’equilibra entre les cèl·lules individuals.
32. Bateria externa: Una unitat de bateria extraïble que es pot connectar a un dispositiu electrònic per subministrar energia.
33. Indicador de càrrega de la bateria: Un indicador o pantalla que mostra l'estat de càrrega o el nivell d'una bateria.
34. Efecte de memòria de la bateria: Un fenomen pel qual la capacitat d’una bateria disminueix gradualment a mesura que es repeteixen els cicles de càrrega i descàrrega, ja que la bateria recorda els intervals de càrrega i descàrrega menors.
35. Impedància: Es refereix a la resistència interna d’una bateria, que afecta la seva eficiència i rendiment de conversió d’energia.
36. Protecció de la temperatura: Una funció o dispositiu que supervisa i controla la temperatura d’una bateria per evitar el sobreescalfament dels danys si la temperatura es fa massa alta.
37. Protecció de baixa tensió: Mecanisme de protecció que talla automàticament el circuit per evitar la descàrrega excessiva quan la tensió de la bateria cau per sota d’un llindar segur.
38. Protecció de sobrecàrrega: Un mecanisme de protecció que talla automàticament el circuit per evitar la sobrecàrrega quan la càrrega de la bateria arriba al llindar de seguretat.
39. Emmagatzematge de la bateria: El procés de retenció d’una bateria en un estat no utilitzat durant un període de temps prolongat, sovint requereix mesures adequades per reduir l’autocàrrega i protegir la bateria.
40. Sistema de gestió de bateries (BMS): Un sistema electrònic per controlar, controlar i protegir l'estat i el rendiment d'un paquet de bateries, incloent la gestió del corrent, la tensió, la temperatura i altres paràmetres.
41. Indicador del nivell de la bateria: Un dispositiu o funció que indica el nivell de càrrega que queda en una bateria, normalment expressat en percentatge o en diverses etapes.
42. Temps de càrrega: El temps necessari per portar una bateria de càrrega baixa a una càrrega completa, que està influenciada per la potència del carregador i la capacitat de la bateria.
43. Coeficient de temperatura: La relació entre el rendiment de la bateria i els canvis en la temperatura, cosa que pot afectar la capacitat, la resistència interna i les característiques de càrrega/descàrrega de la bateria.
44. Garantia de la bateria: La garantia del fabricant sobre el rendiment i la qualitat d’una bateria durant un període de temps determinat, normalment expressat en mesos o anys.
45. Estació de càrrega: Un equip o una instal·lació utilitzada per subministrar vehicles elèctrics o altres equips de bateria per carregar -se.
46. Provador de la bateria: Un dispositiu o instrument utilitzat per mesurar la tensió, la capacitat, la resistència interna i altres paràmetres d'una bateria per avaluar la seva salut i el seu rendiment.
47. Equilibri actiu: Una tècnica de gestió de bateries que iguala la càrrega en un paquet de bateries controlant la taxa de càrrega i descàrrega entre les cèl·lules individuals.
48. Equilibri passiu: Una tècnica de gestió de bateries en què la càrrega en un paquet de bateries està equilibrada connectant resistències o fuites de càrrega, normalment amb menys eficiència que l'equilibri actiu.
49. Embalatge de la bateria : L'embalatge extern d'una bateria, utilitzat per protegir la cel·la, proporcionar suport estructural i prevenir els curtcircuits.
50. Alta densitat energètica: La quantitat màxima d’energia elèctrica que pot emmagatzemar una bateria per un volum o pes, cosa que indica l’eficiència d’emmagatzematge d’energia de la bateria.
51. Taxa de descàrrega d'auto-descàrrega baixa: La velocitat amb la qual una bateria perd energia elèctrica per si sol és molt lenta i manté un estat de càrrega elevat quan s’emmagatzema o no s’utilitza durant un llarg període de temps.
52. Polarització de la bateria: Es refereix al canvi de material a la superfície dels elèctrodes durant la càrrega i la descàrrega a causa de les reaccions químiques als elèctrodes.
53. Bateria Leakage d’electròlits: Una condició en què l'electròlit d'una bateria es filtra a l'entorn extern, que donarà lloc a la degradació del rendiment de la bateria o d'altres problemes de seguretat.
54. Sistema de refrigeració de la bateria: Un sistema que s'utilitza per controlar la temperatura d'una bateria, ja sigui mitjançant la dissipació de calor, el ventilador o el refredament de líquids per mantenir la bateria dins del rang de temperatura de funcionament adequat.
55. Sistema de calefacció de la bateria: Un sistema que s’utilitza per proporcionar calor a la bateria en ambients de baixa temperatura per assegurar el funcionament adequat de la bateria a temperatures baixes.
56. Bateria d’alta velocitat de descàrrega: Una bateria capaç de proporcionar energia elèctrica a un corrent elevat per a aplicacions amb requisits d’alta potència com ara eines elèctriques i vehicles elèctrics.
57. Bateria secundària: Una bateria que es pot recarregar, a diferència d’una bateria d’un sol ús que no es pot recarregar.
58. Monitor de la bateria: Un dispositiu o sistema per controlar l'estat, la tensió, la temperatura i altres paràmetres d'una bateria en temps real per proporcionar informació i protegir la bateria.
- Construcció de bateries: elèctrodes, electròlits i separador.
-
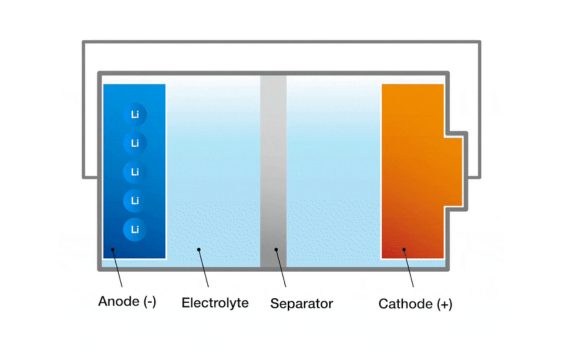
1. Elèctrodes: Els elèctrodes d'una bateria es divideixen en un elèctrode positiu i negatiu.L’elèctrode positiu és on es produeix la reacció d’oxidació a la bateria i l’elèctrode negatiu és on es produeix la reacció de reducció a la bateria.Els elèctrodes positius i negatius estan formats per materials conductors, normalment s’utilitzen metalls, carboni o compostos.La diferència de potencial entre els elèctrodes positius i negatius produeix la tensió de la cèl·lula de la bateria.
2. Electròlit: L’electròlit és el medi entre els elèctrodes que permet que els ions passin entre els elèctrodes i mantinguin el saldo de càrrega.L’electròlit pot estar en forma líquida, sòlida o gel, depenent del tipus de cèl·lula.En una cèl·lula líquida, l’electròlit sol ser un compost iònic dissolt en solució.
3. Diafragma: El diafragma és una barrera física entre els elèctrodes positius i negatius, evitant que el flux d’electrons directe, però permeti passar ions.La funció del diafragma és prevenir el curtcircuit dels elèctrodes positius i negatius alhora que permeten que els ions es moguin lliurement a través de l’electròlit i mantenint l’equilibri de càrrega de la cèl·lula.El diafragma sol ser fabricat amb un material polimèric o un material ceràmic.
Aquests components funcionen junts per formar l'estructura de la cèl·lula de la bateria.
- Processos de càrrega i descàrrega en bateries: reaccions químiques i flux de corrent.
-
1. Procés de descàrrega: Quan es descarrega una bateria, l’energia química es converteix en energia elèctrica.Durant la descàrrega, es produeix una reacció d’oxidació al terminal positiu i una reacció de reducció al terminal negatiu.Les reaccions químiques produeixen electrons i ions.L’elèctrode positiu allibera electrons, que flueixen a través d’un circuit extern per produir un corrent elèctric.L’elèctrode negatiu rep electrons, que es combinen amb ions per formar compostos.Al mateix temps, els ions es mouen per l'electròlit, mantenint l'equilibri de càrrega de la bateria.
2.Procés de recàrrega: Durant la càrrega d’una bateria, l’energia elèctrica es converteix en energia química per emmagatzemar energia.Durant el procés de càrrega, una font d’alimentació externa aplica una tensió cap endavant, fent que un corrent passi per la bateria.La tensió positiva reverteix la bateria i reverteix la reacció química entre els elèctrodes positius i negatius.L’elèctrode positiu accepta electrons i l’elèctrode negatiu els allibera.La reacció química emmagatzema energia elèctrica com a energia potencial química, restablint la bateria al seu estat original.Els ions es mouen per l'electròlit per mantenir l'equilibri de càrrega.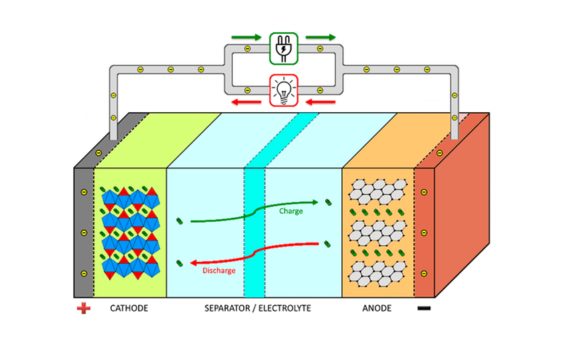
- Tensió, capacitat i densitat d’energia de la bateria.
-
voltatge:
La tensió és una mesura de la força de la sortida elèctrica de la bateria.Normalment s’expressa en volts.Les tensions comunes de la cel·la de la bateria són les següents:
•Bateria d’ions de liti (Li-ion): generalment de 3,6 volts a 3,7 volts.El que és més especial és que la bateria LIFEPO4 (fosfat de ferro de liti) és de 3,2 volts.(Tensió única de la cel·la)
•Bateria de níquel-cadmi (NICD): 1,2 volts (tensió unicel·lular).
•NHidrur d’Ickel-Metal (NIMH): 1,2 volts (tensió d’unicel·lular).
•Bateria de plom-àcid (plom-àcid): 2 volts a 2,2 volts (tensió única cel·lular).Les bateries de plom-àcid s’utilitzen habitualment en l’inici de l’automòbil, els sistemes d’emmagatzematge d’energia i altres camps.
•Bateria de zinc-alcalina (zinc-carboni): 1,5 volts (tensió unicel·lular).Aquest tipus de bateries es troba habitualment en bateries alcalines d’un sol ús com les bateries AA i AAA.
Les anteriors es mostren les tensions de diverses bateries i també podem augmentar la tensió connectant -les en sèrie.Els exemples són els següents:
•Tres bateries de ions de liti de 3,7V estan connectades en sèrie per obtenir una bateria de ions de liti de 11.1V (és a dir, el que sovint anomenem un paquet de bateries de ions de liti de 12V);
•Es connecten tres bateries de 2V-àcid de plom en sèrie per obtenir un paquet de bateries de 6V de plom;
• Quatre bateries de fosfat de ferro de liti de 3,2V es connecten en sèrie per obtenir un paquet de bateries de fosfat de ferro de liti de 12,8V (és a dir, el que sovint anomenem un paquet de bateries de fosfat de ferro de liti de 12V)
Capacitat :
Quan es parla de la capacitat de la bateria, sovint s’expressa mitjançant la unitat d’ampere-hores (AH) o Milliampere-hores (MAH).La capacitat de la bateria és la quantitat de càrrega que pot emmagatzemar una bateria i també es pot entendre com el producte del corrent i el temps que pot lliurar la bateria.A continuació, es mostren algunes figures d’exemple i la forma en què es descriuen:
•Bateria de 2000 mAh: això significa que la bateria té una capacitat de 2000 mAh.Si el dispositiu dibuixa un corrent mitjà de 200 mil·límetres (MA) per hora, aquesta bateria pot subministrar energia durant 10 hores (2000mAh / 200mA = 10 hores).
•Bateria 5AH: Això significa que la bateria té una capacitat de 5 amperis.Si el dispositiu consumeix un corrent mitjà d’1 ampli (a) per hora, aquesta bateria pot alimentar teòricament 5 hores (5AH / 1A = 5 hores).
Els paquets de bateries es poden connectar en paral·lel per donar una capacitat més gran, per exemple:
•Es poden connectar en paral·lel 2 bateries de ions Li de 12V-100AH per obtenir un paquet de bateries de ions Li de 12V-200h.
•2 bateries LIFEPO4 de 3.2V-10AH es poden connectar en paral·lel per obtenir un paquet de bateries LIFEPO4 de 3.2V-20AH.
Carregador de bateries de 1000mAh: es tracta d’un carregador que pot carregar la bateria a un ritme de 1000 mil·límetres (MA) per hora.Si teniu una bateria de 2000mAh, carregar -la amb aquest carregador trigarà teòricament 2 hores (2000mAh / 1000mA = 2 hores) per carregar -lo completament.
A la pràctica, el temps d’ús de la bateria calculat teòricament es pot desviar a causa del desgast de la bateria i d’altres factors.
Densitat energètica:
La densitat d’energia és una mesura de l’eficiència de l’energia emmagatzemada en una bateria.Indica la quantitat d’energia que es pot emmagatzemar per volum d’unitat o pes unitari de la bateria.Les unitats comunes de densitat d’energia són les hores de watt per quilogram (WH/kg) o Watt-hora per litre (WH/L).
•Bateria d’ions de liti: les bateries d’ions de liti tenen una alta densitat d’energia, normalment oscil·lant entre 150 i 250 WH/kg.
•Bateria NIMH: les bateries NIMH tenen una menor densitat d’energia en comparació amb les bateries d’ions de liti.Normalment oscil·len entre 60 i 120 wh/kg.
•Bateria de plom-àcid: les bateries de plom-àcid tenen una densitat d’energia relativament baixa en comparació amb les bateries d’ions de liti.Normalment oscil·len entre 30 i 50 wh/kg.
•Bateria de carboni de zinc: les bateries de zinc-carboni tenen una menor densitat d’energia en comparació amb les bateries d’ions de liti.Normalment oscil·len entre 25 i 40 wh/kg.
- Recomanacions d’emmagatzematge de la bateria
-
L’emmagatzematge adequat de la bateria és essencial per mantenir la salut de la bateria i allargar la seva vida útil.A continuació, es mostren algunes recomanacions per emmagatzemar bateries:
•Temperatura: emmagatzemar les bateries en un lloc fresc i sec amb una temperatura entre 15 ° C i 25 ° C (59 ° F i 77 ° F).Les temperatures altes poden accelerar la taxa de descàrrega pròpia i reduir la vida útil de la bateria.Eviteu exposar les bateries a calor o fred extrem.
•Eviteu la humitat: la humitat pot danyar les bateries, provocant corrosió o fuites.Manteniu les bateries allunyades dels entorns humits, com ara soterranis o banys.Assegureu-vos que la zona d’emmagatzematge estigui seca i ben ventilada.
•Nivell de càrrega: abans d’emmagatzemar les bateries durant un període prolongat, el millor és assegurar -se que es carreguen parcialment.La majoria dels fabricants recomanen un nivell de càrrega d’uns 40% al 60% per a l’emmagatzematge a llarg termini.Aquest rang ajuda a prevenir les condicions de sobrecàrrega o sobrecàrrega durant l'emmagatzematge.
•Tipus de bateria: diferents químics de bateries tenen requisits d’emmagatzematge específics.A continuació, es mostren algunes directrius per a tipus comuns:
a. Bateries alcalines: les bateries alcalines tenen una llarga vida útil i es poden guardar durant diversos anys.No són recarregables i no s’han d’exposar a temperatures extremes.
b. Bateries d’ions de liti: bateries de ions Li generalment d’alimentació d’electrònica portàtil.Si teniu previst emmagatzemar -los durant un període prolongat, tingueu en compte un nivell de càrrega entre el 40% i el 60%.Eviteu emmagatzemar les bateries de ions de Li a tota càrrega o descarregades completament.
c. Bateries de plom-àcid: S’utilitzen habitualment en vehicles i sistemes d’energia de còpia de seguretat.Per a l’emmagatzematge a llarg termini, mantingueu les bateries de plom-àcid completament carregades.Comproveu regularment els nivells d’electròlits i remeneu -ho amb aigua destil·lada si cal.
d. Les bateries basades en níquel (NIMH i NICD): les bateries NIMH i NICD s’han d’emmagatzemar a una càrrega parcial (al voltant del 40%).Si es descarreguen completament abans de l’emmagatzematge, poden desenvolupar depressió de tensió, reduint la seva capacitat global.
•SEmmagatzematge de l’Eparat: emmagatzemar les bateries de manera que eviti el contacte entre els seus terminals.Si els terminals positius i negatius es toquen o entren en contacte amb materials conductors, pot causar descàrrega i danys potencials.
•Embalatge original: els envasos originals estan dissenyats per protegir les bateries de la humitat, la pols i altres contaminants.
•Inspecció regular: inspeccioneu periòdicament les bateries emmagatzemades per a qualsevol signe de fuites, corrosió o danys.Si observeu algun problema, gestioneu -los amb cura i disposeu -los correctament.
- Impacte ambiental.
-
Reciclatge de la bateria: Les bateries contenen diversos productes químics i metalls que poden ser perjudicials per al medi si no es disputen adequadament.El reciclatge de bateries ajuda a recuperar materials valuosos com liti, cobalt i níquel i impedeix l’alliberament de substàncies tòxiques.Moltes comunitats disposen de programes de reciclatge de bateries o ubicacions desplegables.Consulteu les autoritats locals o els centres de reciclatge per trobar les opcions d’eliminació adequades a la vostra zona.
Substancies perilloses: Algunes bateries, com les bateries de plom-àcid utilitzades en vehicles, contenen substàncies perilloses com el plom i l’àcid sulfúric.L’eliminació incorrecta d’aquestes bateries pot contaminar fonts d’aigua i sòl, i suposa un risc per a la salut humana i el medi ambient.A mesura que les persones prenen més consciència de la protecció ambiental, cada cop són més les persones que utilitzen bateries d’ions de liti més respectuosos amb el medi ambient, especialment les bateries de LifePo4.
Consum d'energia: La producció de bateries requereix energia i l’impacte ambiental varia en funció del tipus de bateria.Per exemple, la producció de bateries d’ions de liti utilitzades en molts dispositius electrònics i vehicles elèctrics implica l’extracció i el processament de minerals.L’ús de dispositius eficients energèticament i l’optimització de l’ús de la bateria pot ajudar a reduir el consum d’energia global.
Petjada de carboni: La petjada de carboni associada a la producció i eliminació de bateries pot contribuir a les emissions de gasos d’efecte hivernacle i al canvi climàtic.L’augment de l’adopció de fonts d’energia renovable per a la fabricació i el reciclatge de bateries pot ajudar a mitigar l’impacte ambiental.